Proponen un mecanismo molecular para controlar la formación de lazos en el ADN
Un equipo del CSIC describe un mecanismo para controlar la formación de lazos de ADN por las proteínas llamadas cohesinas, implicadas en procesos cancerígenos y en enfermedades raras
Un equipo del CSIC describe un mecanismo para controlar la formación de lazos de ADN por las proteínas llamadas cohesinas, implicadas en procesos cancerígenos y en enfermedades raras
Los complejos de proteínas y ADN dentro de la célula se comportan como verdaderas nanomáquinas. Sobre el funcionamiento de algunos de ellos ya conocemos mucho, pero en otros casos apenas estamos empezando a obtener una idea general de cómo se comportan. El complejo de cohesinas es uno de estos últimos, formado por un grupo de proteínas clave en procesos de transcripción y replicación del ADN. Estas proteínas cobran particular relevancia en diferentes tipos de cáncer y en el contexto de enfermedades raras, como el Síndrome de Cornelia de Lange, un trastorno genético que provoca retraso en el crecimiento, dismorfia facial y defectos en las extremidades, entre otros síntomas.
Lo que hasta ahora se conoce es que la función del complejo de cohesinas consiste en generar, de forma controlada, grandes lazos de ADN. Pero poco se sabe sobre sus mecanismos de control. Usando herramientas de simulación computacional, el grupo de Modelado Molecular del Centro de Biología Molecular Severo Ochoa (CSIC-UAM), dependiente del Ministerio de Ciencia, Innovación y Universidades (MICIU), ha propuesto por primera vez un mecanismo de trinquete, con la implicación de las proteínas STAG2 y RAD21. Este mecanismo permite el alargamiento unidireccional de los lazos de ADN, bloqueando al mismo tiempo el retroceso y, por tanto, el acortamiento de estos lazos.
En los últimos años, grupos de investigación de primera línea en todo el mundo han propuesto varios mecanismos para explicar cómo se forman los lazos de ADN a partir de la estructura del complejo de cohesinas. “Algunos han propuesto mecanismos tipo oruga, en los que las proteínas avanzan sobre el ADN como una oruga sobre una rama. Otros proponen mecanismos de bombeo, similares a los de oruga, pero sin movimiento reptante del complejo. Independientemente del tipo de avance, todos estos modelos necesitarían un sistema que impidiese que el complejo proteico se deslizase hacia atrás una vez que ha empujado el ADN hacia adelante”, explican los investigadores del CBM David Ros-Pardo, Íñigo Marcos-Alcalde y Paulino Gómez-Puertas. Sin embargo, hasta la fecha, no se ha propuesto un componente del sistema con función de mecanismo de bloqueo, capaz de ofrecer una direccionalidad al proceso.
Esta es la principal novedad del reciente estudio publicado en la revista International Journal of Biological Macromolecules, que propone un papel para dos de las proteínas del complejo, STAG2 y RAD21, que actuarían como un sistema de seguridad capaz de permitir el avance, pero no el retroceso. “Este sistema funcionaría como un mecanismo de trinquete, similar a la lengüeta de una brida de plástico, que permite que la cinta de la brida avance, pero solo en un sentido”, añaden los investigadores. El conjunto STAG2/RAD21 permitiría el deslizamiento unidireccional del ADN, facilitando por tanto la extensión de los lazos e impidiendo su colapso.
Técnicas computacionales para estudiar el ADN
Para realizar este estudio se han utilizado técnicas computacionales de modelado molecular dinámico, tanto a escala atómica como a escalas ligeramente superiores, conocidas como simulaciones "de grano grueso". Este tipo de aproximaciones permiten tiempos de simulación de varios microsegundos en sistemas complejos, es decir, sistemas que contienen varias proteínas moviéndose a lo largo de hebras de ADN de más de un centenar de pares de bases de longitud. Todo ello se ha conseguido gracias a sistemas de computación de alto rendimiento, como los alojados en el Centro de Cálculo Científico de la Universidad Autónoma de Madrid (UAM), integrado en la Red Española de Supercomputación.
Este estudio permite, por primera vez, comprender la regulación de la formación de lazos de ADN, un mecanismo clave en procesos celulares como la expresión génica o la división celular. “De forma muy importante, ofrece una visión mecanística del bloqueo del deslizamiento de ADN y convierte a las proteínas STAG2 y RAD21 en nuevas posibles dianas en el desarrollo de medicamentos”, explican los científicos del CBM. Estos fármacos podrían ser capaces de detener o regular la división celular como futuros tratamientos anticancerígenos o como posibles tratamientos para el Síndrome de Cornelia de Lange y otras enfermedades raras relacionadas.
CBM - CSIC Comunicación
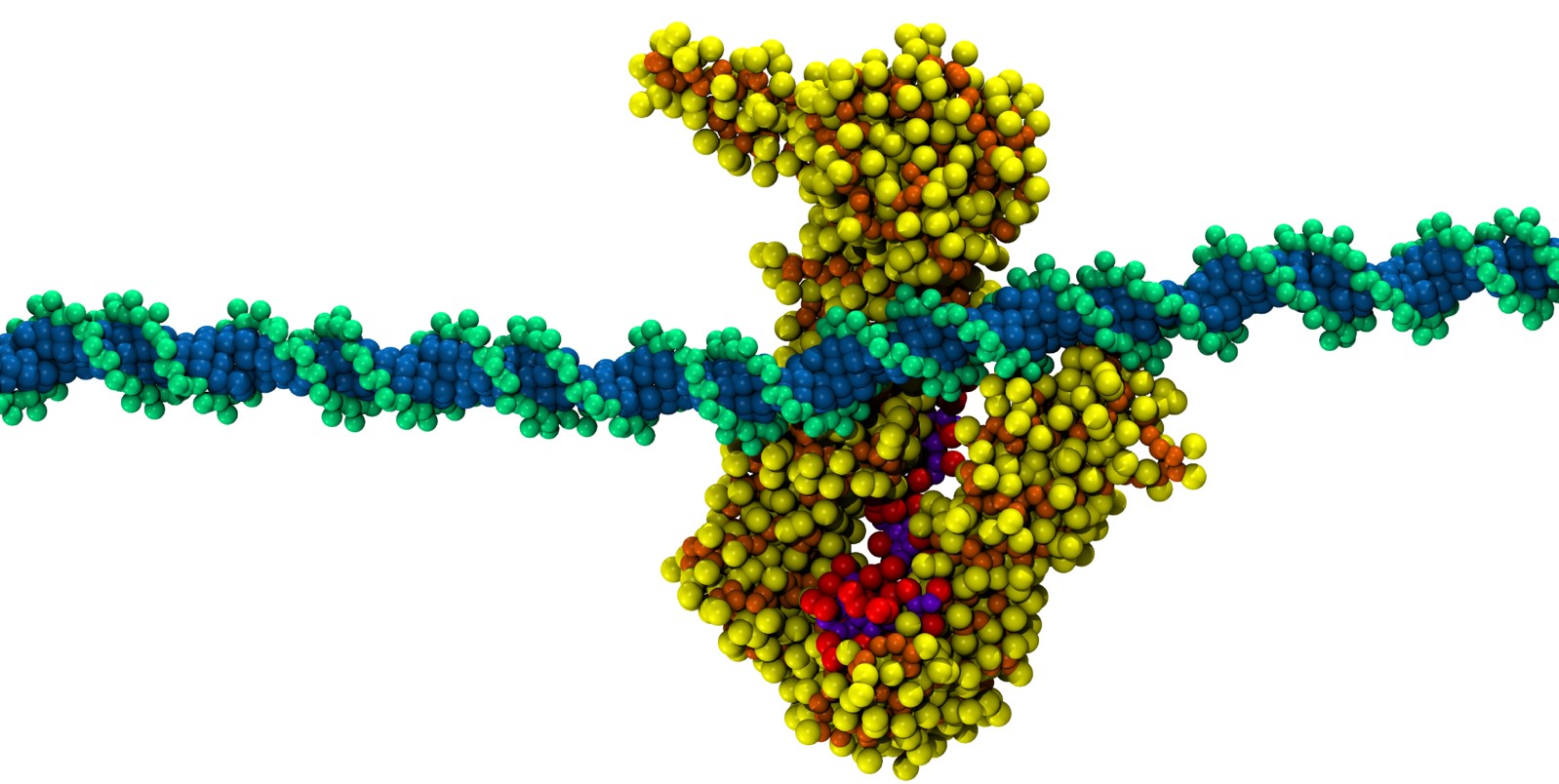
Ros-Pardo, D., Gómez-Puertas, P. & Marcos-Alcalde, I. STAG2-RAD21 Complex: a Unidirectional DNA Ratchet Mechanism in Loop Extrusion. International Journal of Biological Macromolecules. 10.1016/j.ijbiomac.2024.133822
Noticias relacionadas
Un estudio internacional publicado en la …
Un estudio del Instituto de Gestión de la Innovación y del Conocimiento (…
Las comunidades bacterianas naturales son esenciales para la vida en la…