Metástasis: el peligroso viaje del cáncer hacia otros órganos y tejidos
El CSIC trabaja para desentrañar los mecanismos por los que células cancerígenas migran desde un tumor primario para asentarse en otros tejidos y producir tumores secundarios
El CSIC trabaja para desentrañar los mecanismos por los que células cancerígenas migran desde un tumor primario para asentarse en otros tejidos y producir tumores secundarios
Hasta hace unas décadas, el arsenal contra el cáncer se limitaba a cirugía, quimioterapia y radioterapia. En la actualidad, hay terapias más personalizadas y eficaces: dirigidas, inmunoterapia, terapia hormonal, fotodinámica y otros avances, que han hecho más selectivos los tratamientos contra las células malignas.
Con el nuevo arsenal la supervivencia ha aumentado. Sin embargo, este logro queda ensombrecido por la aparición de metástasis, es decir, la generación de tumores secundarios, que suelen ser resistentes a los tratamientos que acabaron con el tumor del que derivan.
Incluso cuando el cáncer puede parecer vencido, algunas células escapadas del tumor inicial pueden haberse asentado en otros órganos, escondidas, invisibles para el sistema inmune. Y pueden pasar años hasta que den la cara. Aunque con mal pronóstico: el 90% de los fallecimientos por cáncer se deben a las metástasis. De ahí que desentrañar todos sus secretos sea una prioridad. El CSIC cuenta con diversos equipos de investigación que indagan en los mecanismos de la metástasis para generar el conocimiento básico que pueda servir para futuros métodos de detección y tratamientos.
En el Instituto de Neurociencias de Alicante (IN-CSIC-UMH), centro mixto del CSIC y la Universidad Miguel Hernández de Elche, el equipo de la bióloga Ángela Nieto investiga uno de los mecanismos fundamentales de la cascada de reacciones metastásicas, la denominada transición epitelio-mesénquima. Se trata de un proceso que cumple una función esencial en el desarrollo del embrión, porque permite que células inmóviles epiteliales se conviertan en células móviles que pueden desplazarse para formar los órganos y los tejidos del embrión en formación.
Estas células móviles están programadas para que dejen de moverse una vez que hayan cumplido su función en el desarrollo del embrión. Paradójicamente, este mecanismo que es fundamental para la vida del embrión, puede ser muy nocivo si se reactiva en la edad adulta, puesto que puede facilitar que las células tumorales se propaguen y colonicen otros tejidos y órganos, donde pueden llegar a generar tumores secundarios.
“Hay que seguir estudiando los tumores primarios, sobre todo la heterogeneidad celular. Las células de un tumor no son todas iguales, incluso se pueden encargar de distintas funciones. Y los tumores evolucionan, adquieren nuevas mutaciones que modifican su malignidad”, advierte Nieto. “Pero, además, ahora hay que poner el foco en el análisis del nicho metastásico: el entorno en el que las células diseminadas por la activación de los genes embrionarios van a colonizar”, indica.
Las vías de comunicación interna de las células
“La metástasis es el punto clave en el abordaje del cáncer”, señala Berta Casar, investigadora del CSIC en el Instituto de Biomedicina y Biotecnología de Cantabria (IBBTEC), en Santander. Casar, formada en The Scripps Research Institute (en EEUU), dirige un grupo que indaga en los procesos moleculares que regulan la metástasis del melanoma (el cáncer de piel más agresivo), cáncer de próstata y cáncer de páncreas.
En estos procesos desempeñan una función clave las proteínas kinasas, “que son una especie de mensajeros internos de las células sensibles a estímulos externos y que transmiten señales a las células para que inicien diversas actividades en respuesta”, resume Casar. Las kinasas son un tipo de proteína implicadas en dirigir la respuesta de las células a diversos estímulos, como pueden ser factores de crecimiento, citoquinas, virus o carcinógenos. Sobre todo, las proteínas kinasas regulan funciones clave de las células, como la proliferación, la expresión genética, la diferenciación, la mitosis, la supervivencia celular y la muerte celular programada, todos ellos procesos fundamentales en el origen y evolución del cáncer.
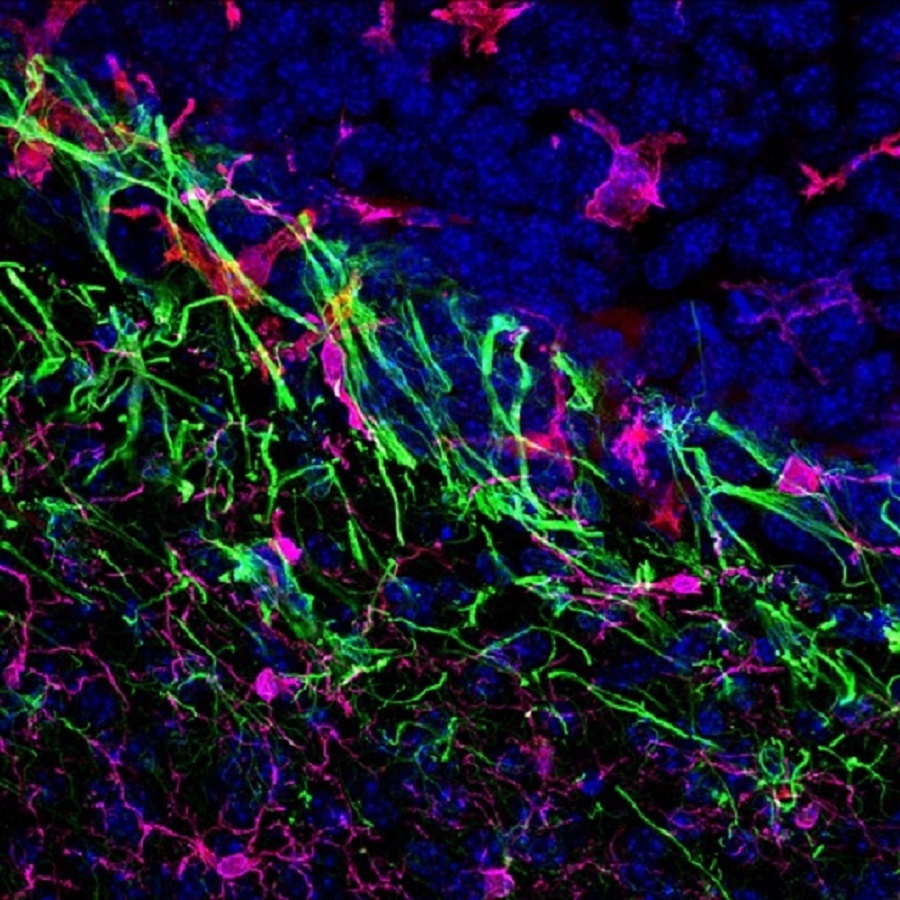
Imagen de células tras sufrir la transición epitelio mesénquima, que da movilidad a las células. /IN
“En nuestro grupo utilizamos un abordaje multidisciplinar, que consiste en el uso de líneas tumorales, modelos animales y muestras de pacientes, para comprender cómo la activación de las proteínas kinasas induce la progresión tumoral y la resistencia a las terapias convencionales”, explica Casar. Este tipo de proteínas podría convertirse en una diana para fármacos en el tratamiento de la metástasis.
“Hemos identificado que la activación específica de la proteína kinasa ERK induce la invasión y metástasis del melanoma, cáncer de pulmón y cáncer de mama”, indica Casar. “Además, estamos estudiando la capacidad que tienen las células tumorales para adaptarse y desarrollar resistencia modificando sus perfiles de activación de proteínas específicas. Este mecanismo es fundamental para comprender la malignidad del cáncer, puesto permite que las células tumorales desarrollen resistencias tanto a terapias dirigidas como a inmunoterapias, y esto favorece la aparición de la enfermedad metastásica”, añade. Casar considera que podrían utilizarse fármacos que bloqueen la actividad de estas proteínas en el tratamiento de cáncer.
Además, la fosforilación en los residuos específicos de estas proteínas [la fosforilación es una reacción que ocurre en respuesta a factores de crecimiento, hormonas o fármacos] podría servir como biomarcadores de resistencia para estatificar mejor a los pacientes con melanoma, cáncer de pulmón o cáncer de mama.
La resistencia de los tumores a las terapias plantea un desafío considerable. En el caso del melanoma, por ejemplo, cada año se diagnostican 250.000 casos en el mundo y unas 50.000 personas reciben un tratamiento que no les resultará efectivo, sufriendo sus efectos secundarios y consumiendo recursos del sistema de salud. “Para saber si un paciente va a responder bien al tratamiento hemos desarrollado un método basado en un anticuerpo específico, protegido mediante patente, y que en un futuro podría ser un biomarcador predictivo de respuesta”, revela Casar.
“Si somos capaces de entender los mecanismos moleculares que hacen a las células tumorales tan adaptables a los fármacos, podremos prevenir la aparición de resistencia a tratamientos, mejorar el pronóstico y el tratamiento de estos pacientes mediante una medicina personalizada”, augura la investigadora.
Células móviles que se propagan
La mayoría de las células metastásicas que alcanzan el torrente sanguíneo mueren antes de llegar a otros órganos. “Solo unas pocas adquieren los superpoderes necesarios para evadir de forma casi inteligente el ambiente adverso que encuentran en los diferentes órganos que colonizan”, explica el investigador del CSIC Toni Celià-Terrassa, que coincide en resaltar que el reto en la lucha contra el cáncer está en curar las metástasis.
El investigador Celià-Terrasa estudia los mecanismos por los que las células madre mamarias malignas se protegen del sistema inmunitario. Hizo su tesis en el Instituto de Biología Molecular de Barcelona (IBMB-CSIC), con el investigador Timothy Thomson.
De aquel trabajo, en 2012 publicó un estudio dirigido por Thomson en el que informaban de que la transición epitelio-mesénquima, que confiere movilidad a las células para diseminarse, tenía que revertirse al llegar a los órganos diana, donde las células invasoras debían mantener las propiedades de célula madre para poder proliferar.
“Poco después, el laboratorio de Ángela Nieto, referencia mundial en transición epitelio-mesénquima, publicó de forma más robusta otro estudio muy importante y alineado con el nuestro”, explica Celià-Terassa. Estos trabajos supusieron un cambio de paradigma en cómo la transición epitelio-mesénquima contribuye a la diseminación del cáncer.
Durante su estancia posdoctoral en el laboratorio del doctor Yibin Kang, experto en metástasis en cáncer de mama de la Universidad de Princeton (en EEUU), Celià-Terrassa pudo indagar más en las propiedades de las células metastásicas, semejantes a las de las de las células madre, que las confieren ventajas para colonizar los diferentes órganos. “Estudié los diferentes tipos de la transición epitelio-mesénquima y encontramos que las células madre cancerosas responden poco al interferón del ambiente tumoral”. El interferón es producido en respuesta a la presencia de diversos patógenos y células tumorales. “Ahora nos centramos en estudiar cómo son reconocidas las células metastásicas en el cáncer de mama, y en cómo podemos potenciar la respuesta del interferón para que respondan a la inmunoterapia”, explica.
Melanoma y metástasis cerebral
La investigadora Berta L. Sánchez-Laorden es experta en metástasis cerebrales. Desarrolla su trabajo en el IN. Se centra en la metástasis del melanoma, que junto con el cáncer de mama y del pulmón es uno de los tumores que más frecuentemente metastatiza el cerebro.
Sánchez-Laorden se ha formado en el Instituto Nacional del Cáncer de Estados Unidos y el Imperial College (Reino Unido), donde realizó una extensa labor de investigación en melanoma. A mediados del 2014, retornó a España y comenzó a trabajar en el IN con la profesora Nieto. Desde 2017 dirige el laboratorio de Plasticidad Fenotípica en Melanoma de este Centro de Excelencia Severo Ochoa.
Sus investigaciones han ayudado a entender aspectos clave de la biología del melanoma: los mecanismos que promueven su aparición, metástasis y su resistencia a terapias. Su perfil aúna conocimientos previos en cáncer con los adquiridos en un centro dedicado al estudio del cerebro como el IN.

Berta L. Sánchez-Laorden, del IN, estudia la metástasis del melanoma. / IN
Su laboratorio está interesado en la contribución de la reactivación de factores del desarrollo embrionario a la progresión del melanoma y en averiguar cómo el microambiente tumoral favorece el crecimiento de metástasis en el cerebro, lugar preferencial en este tipo de cáncer.
“Queremos entender cómo la interacción entre las células de melanoma y las células residentes en el cerebro promueve la metástasis cerebral. Estamos especialmente interesados en la microglía, que son las células del sistema inmune residentes en el cerebro, y en la oligodendroglía, otra población de células que podría regular el crecimiento de las metástasis”, explica.
Pese a que el desarrollo de las terapias dirigidas y la inmunoterapia ha mejorado considerablemente el tratamiento del melanoma, “los pacientes que desarrollan metástasis en el cerebro tienen una baja supervivencia porque no responden al tratamiento, debido a las características únicas del microambiente en el cerebro, diferentes al resto de los órganos”, explica.
Hay más factores que dificultan combatir las metástasis en el cerebro. Entre ellos, la barrera hematoencefálica, que aísla y protege al cerebro de sustancias extrañas, incluidos los fármacos. Otro factor que juega en contra es el sistema inmune del cerebro, que se activa con la llegada de las primeras células metastásicas y produce inflamación. Esta inflamación es beneficiosa durante un tiempo limitado, pero a largo plazo favorece el crecimiento del tumor. “Las células del tumor adiestran a las del sistema inmune del cerebro y las convierten en aliadas para desarrollar metástasis”, explica la doctora Sánchez-Laorden.
Con el objetivo de diseñar mejores estrategias terapéuticas, su grupo hace un abordaje multidisciplinar, desde la oncología y la neurociencia, “que nos permite entender la biología del melanoma con metástasis cerebral y ver cómo evoluciona el sistema inmune cerebral en respuesta a los tratamientos”, explica.
El entorno que facilita la migración tumoral
Desde el Centro de Investigación del Cáncer de Salamanca (CIC-CSIC-USAL), centro mixto del CSIC y la Universidad de Salamanca,, el químico Miguel Vicente-Manzanares estudia cómo la célula cancerosa interacciona con su entorno para migrar a otros lugares.
En 2020 vieron que la miosina 2, “una proteína motora que convierte energía química en mecánica”, regula la rigidez de los tejidos y es capaz de actuar de sensor molecular para que la célula decida si puede moverse o no. “Esto es muy importante en el entorno tumoral, porque permite formar metástasis en localizaciones diferentes al tumor primario”, resalta Vicente-Manzanares.
Parte del proceso de formación de tumores sólidos implica un cambio en la rigidez, explica este experto, porque las células proliferan y migran mejor cuanto más rígido es el entorno. “Igual que los atletas, que prefieren correr en una pista de asfalto, porque es más fácil el agarre”, aclara Vicente-Manzanares.
En un entorno más rígido, aumenta la actividad de la miosina, que tensa las células y hace a su vez el entorno más rígido, creando un círculo vicioso, precisa. Ahora, dando una nueva vuelta de tuerca a sus investigaciones, quiere vigilar de cerca esta proteína motora: “Somos bastante fuertes en microscopía, y, junto con Alberto Pendás, también del CIC, hemos adquirido dos equipos de microscopía de superresolución. Uno de ellos, de microscopía de campo evanescente combinado con optogenética, permite manipular las células con luz y ver procesos del orden de milisegundos. Algo imposible para la microscopía óptica”, detalla.
“El otro microscopio, de localización de molécula única, con una mezcla de alta resolución, alta velocidad y algorítmica, permite inferir la posición de una sola molécula dentro de la célula y si está activa o inactiva, anclada a la membrana o forma parte de un flujo citoplasmático. Estas técnicas se llevan aplicando bastantes años por separado, pero la conjunción de todas aplicada al cáncer es pionera”, destaca Vicente-Manzanares.
Anticuerpos para el cáncer colorrectal
Una técnica clásica es el desarrollo de anticuerpos terapéuticos para el tratamiento de metástasis tumorales. Es el enfoque del laboratorio de Ignacio Casal, del Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC), en Madrid. En una publicación de enero de 2020, el equipo de Casal descubrió que la inhibición de la proteína tirosina fosfatasa-1B interrumpe la invasión y la metástasis promovidas por IL13Rα2 en las células cancerosas. “El uso de inhibidores específicos de proteína tirosina fosfatasa-1B representa una estrategia terapéutica prometedora en múltiples tipos de cáncer, incluido el glioblastoma”, asegura Casal.
Imagen confocal de células en mitosis. / CIB
En otro trabajo más reciente, de abril de 2021, el equipo de Casal, ha descrito la capacidad de un anticuerpo monoclonal especifico de IL13Rα2 para bloquear la señalización de IL-13 mediada por IL13Rα2 en células de cáncer colorrectal. “Este bloqueo de la señalización por el anticuerpo resulta en una inhibición completa de la metástasis hepática causada por el cáncer colorrectal y presenta por tanto importantes aplicaciones terapéuticas”, indica Casal.Todas las aproximaciones suman cuando se trata de vencer a un enemigo tan cruel como la metástasis. El cáncer 2.0.
Pilar Quijada Garaballu / CSIC Comunicación
Noticias relacionadas
Un estudio internacional publicado en la …
Un estudio del Instituto de Gestión de la Innovación y del Conocimiento (…
Las comunidades bacterianas naturales son esenciales para la vida en la…

