Científicos del CSIC identifican un nuevo mecanismo que regula el desarrollo del citoesqueleto del intestino
Este esqueleto celular es esencial en la formación del intestino y la correcta absorción de los nutrientes
Este esqueleto celular es esencial en la formación del intestino y la correcta absorción de los nutrientes
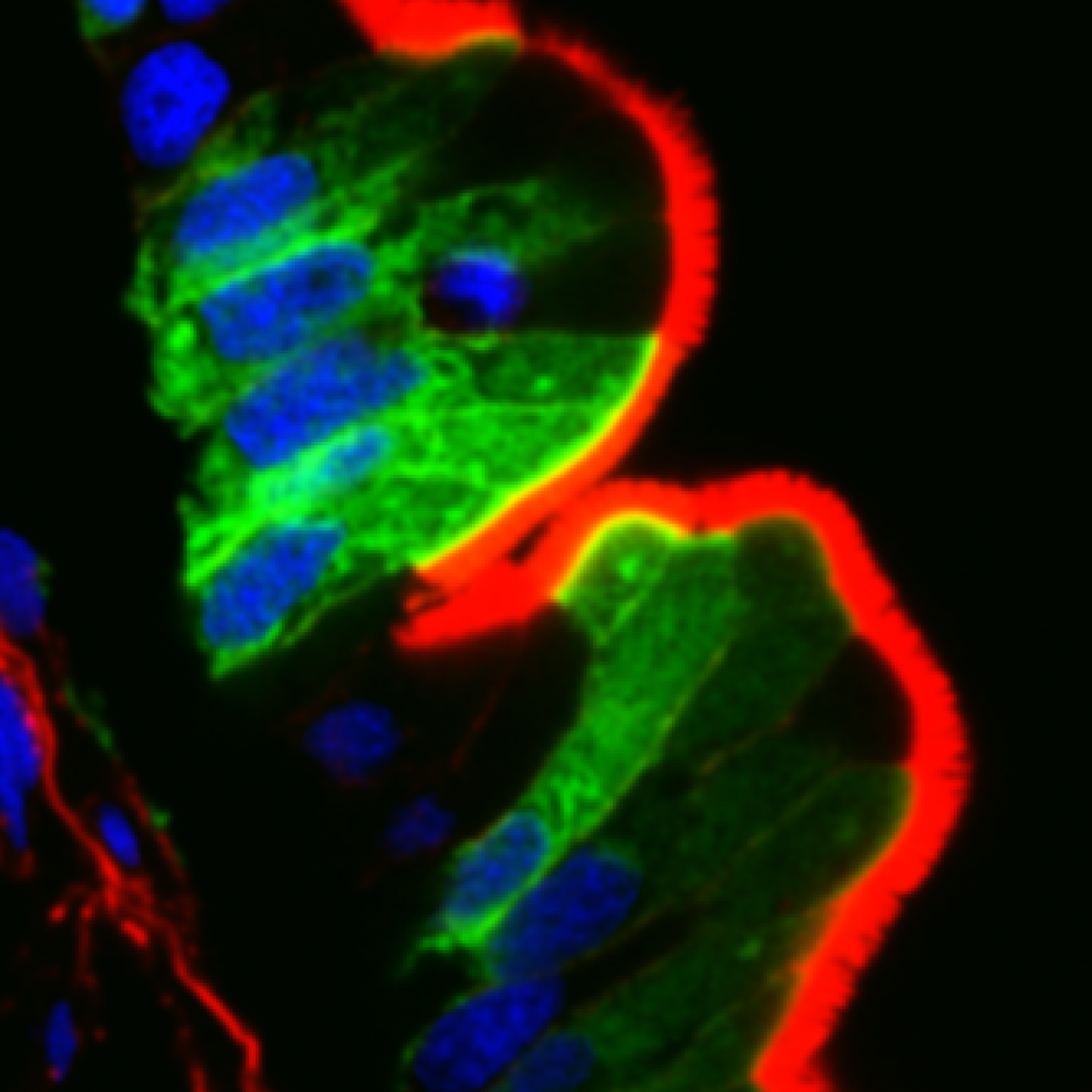
Un equipo liderado por investigadores del Consejo Superior de Investigaciones Científicas (CSIC), y en el que han colaborado la Universidad de Harvard (Boston) y la Universidad de Duke (Durham), ha identificado un nuevo mecanismo que regula el desarrollo normal del esqueleto de las células del intestino, esencial para la formación de las microvellosidades intestinales en mamíferos y, por tanto, para su funcionamiento normal. El trabajo, llevado a cabo en el modelo de pez cebra y publicado en el último número de la revista Current Biology, puede contribuir a la identificación de dianas terapéuticas para el tratamiento de ciertas afecciones intestinales genéticas y cáncer epitelial.
Una de las preguntas fundamentales en biología celular es cómo los tejidos adquieren su forma y función durante el desarrollo. Se ha establecido que la remodelación dinámica del esqueleto celular es uno de los principales mecanismos responsables de estos cambios morfológicos. Durante el desarrollo intestinal, las células epiteliales se reorganizan para formar una estructura en forma de dedos llamadas microvellosidades, que aumentan la superficie del tejido para la absorción de nutrientes. La generación de estas microvellosidades requiere el ensamblaje de una malla de citoesqueleto tridimensional localizada debajo de la membrana celular, conocida como la red terminal. Sin embargo, los pasos moleculares para su formación aún no están claros.
Aunque la maduración de la red terminal es un proceso que lleva días, rara vez se ha planteado que la modulación de la expresión genética podría ser un actor principal en este proceso, especialmente en los vertebrados. Esto está en marcado contraste con otros tipos de células, como las células musculares, en las que la expresión génica cambia drásticamente durante su formación. “Presumimos que un mecanismo similar podría modular la remodelación de la corteza de las células epiteliales”, explica el investigador del CSIC Fernando Martín-Belmonte, que trabaja en el Centro de Biología Molecular Severo Ochoa (CBM-CSIC-UAM) y que lidera este trabajo.
Una nueva diana terapéutica
El estudio demuestra que el gen SMTNL2 (Smoothelin Like 2) controla la maduración del esqueleto celular en las células epiteliales. Las alteraciones de las microvellosidades están asociadas a patologías entero genéticas o adquiridas. Además, las anomalías de la corteza celular asociadas al déficit de este gen e identificadas en este trabajo son características de las células malignas altamente metastásicas.
Trabajos anteriores llevados a cabo por este mismo grupo establecieron que la expresión de Smoothelin está asociada a diferentes tipos de cáncer epitelial. “Será interesante medir los niveles de expresión y actividad de este gen durante la invasión o migración de células tumorales y determinar si se requiere para la progresión del carcinoma de colon. Futuros estudios podrían ser fundamentales para dilucidar la base molecular de los defectos intestinales congénitos y proporcionar una nueva perspectiva sobre la oncogénesis y la metástasis intestinal”, concluye Martín-Belmonte.
CSIC Comunicación
Mariam Hachimi; Catalina Grabowski; Silvia Campanario; Gonzalo Herranz; Gabriel Baonza; Juan M. Serrador; Sergio Gomez-Lopez; Maria D.Barea; Minerva Bosch-Fortea; Darren Gilmour; Michel Bagnat; Alejo E.Rodriguez-Fraticelli; Fernando Martin-BelmonteSmoothelin-like 2 Inhibits Coronin-1B to Stabilize the Apical Actin Cortex during Epithelial Morphogenesis. Current Biology. DOI: 10.1016/j.cub.2020.11.010
Noticias relacionadas
Un estudio del Instituto de Investigaciones Biomédicas Sols-Morreale…
El cáncer de páncreas es uno de los más agresivos y con una de las…
Palpar para conocer. Esta ha sido la base de la medicina desde sus…